联系人:邢先生 | 手机号码:138-1092-1567
三阴性乳腺癌因生物学恶性程度高、侵袭力强、预后较差,长期以来是乳腺癌临床诊疗的重点和难点。1月29日,复旦大学附属肿瘤医院乳腺外科余科达教授团队发表的一项研究成果,揭示了抑制三阴性乳腺癌进展的新路径:蛋白EMSY通过重塑肿瘤代谢微环境,增强甲硫氨酸代谢实现对靶基因的调控,从而促进乳腺癌干细胞的富集以及肿瘤生长;并通过小动物模型证实“甲硫氨酸剥夺饮食”可特异性地清除肿瘤干细胞,最终抑制肿瘤进展,有望成为诊疗三阴性乳腺癌的新策略。该项成果在同日在国际权威学术期刊《细胞报告医学》在线发表,影响因子14.3。
余科达教授介绍说,肿瘤干细胞是癌组织中存在的一小群具有肿瘤形成能力、可以自我更新、分化程度较低的特殊肿瘤细胞群,是肿瘤诊疗领域关注研究的重点。乳腺癌组织中也存在一小群肿瘤干细胞,称之为乳腺癌干细胞。既往研究证实乳腺癌干细胞是乳腺癌治疗耐受、复发和转移的关键因素,尤其是在“最毒”乳腺癌——三阴性乳腺癌的进展中扮演了不可或缺的角色,靶向肿瘤干细胞治疗有望是三阴性乳腺癌治疗的一个重要策略。

为证实这一猜想,余科达教授团队展开了系列研究。该研究通过复旦大学附属肿瘤医院三阴性乳腺癌队列的多组学数据整合分析、细胞功能实验、小鼠模型以及临床样本验证,鉴定出多个在三阴性乳腺癌干细胞亚群扩增表达且明显影响ALDH阳性(BCSC经典标志物)细胞富集比例的重要分子;其中,可以诱导肿瘤细胞产生类似BRCA突变表型的蛋白EMSY,引起了研究团队的注意。
在后续的研究中发现,蛋白EMSY在三阴性乳腺癌干细胞群体中扩增高表达,促进ALDH+ 细胞富集,增强肿瘤干细胞的自我更新和肿瘤起始能力,并与三阴性乳腺癌患者的不良预后呈明显正相关。
研究团队进一步探究蛋白EMSY调控三阴性乳腺癌的机制,发现EMSY竞争性地结合在KDM5B的JmjC结构域,这一结构域对KDM5B酶活性至关重要;EMSY抑制KDM5B酶活性从而调控甲硫氨酸代谢状态和H3K4me3甲基化水平,促进乳腺癌干细胞自我更新和肿瘤发生。此外,在EMSY扩增的TNBC-PDX模型中,PARP抑制剂(尤其是非肿瘤干细胞)和甲硫氨酸剥夺(尤其是肿瘤干细胞)联合治疗更好地杀伤肿瘤细胞,降低乳腺癌干细胞比例,抑制肿瘤生长。
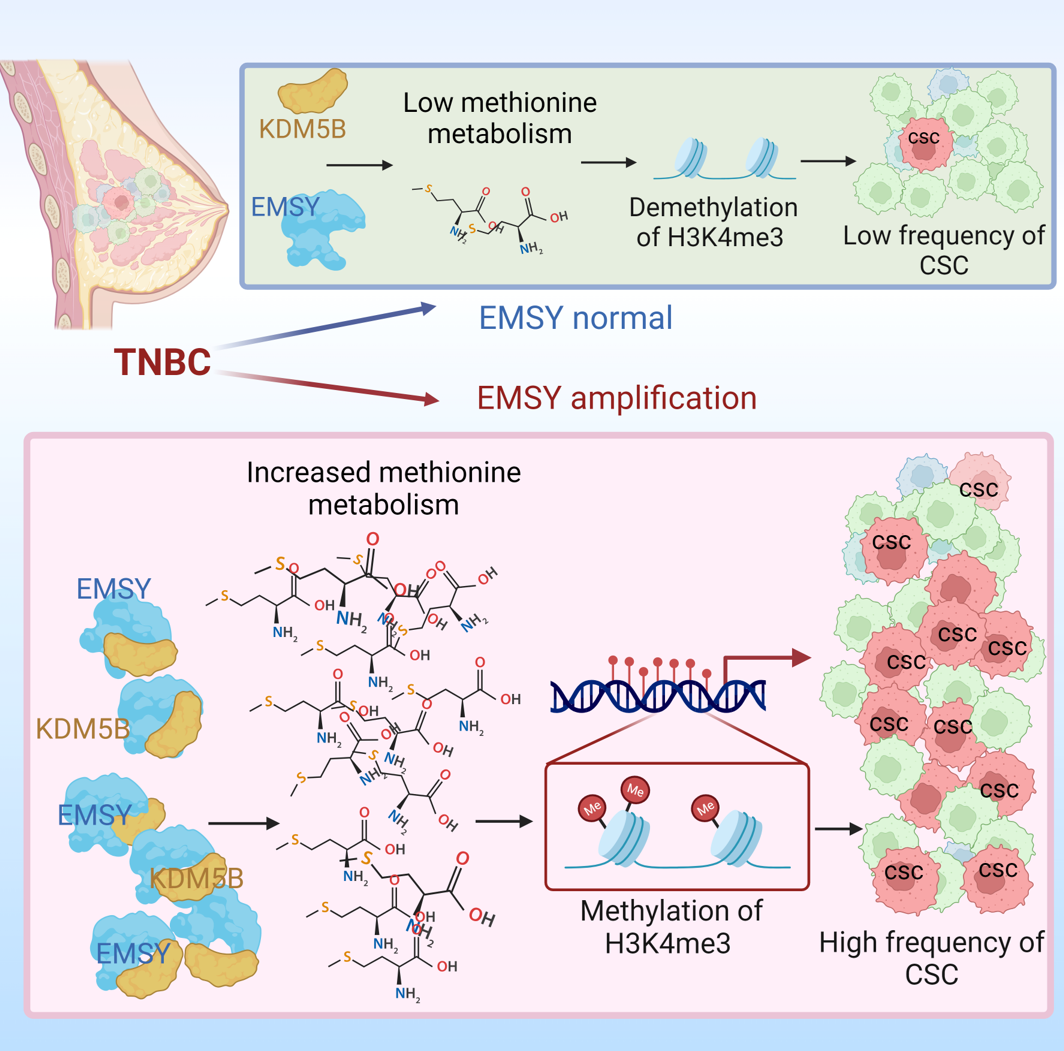
余科达教授表示,该研究阐释了EMSY介导的甲硫氨酸代谢对肿瘤干细胞调控作用以及三阴性乳腺癌进展的新分子机制,提出并证实PARP抑制剂和饮食中甲硫氨酸剥夺的联合治疗策略。表明肿瘤干细胞独特的氨基酸代谢特征并靶向其脆弱性将会是临床上清除肿瘤干细胞的重要手段,可作为治疗肿瘤的新策略。
复旦大学附属肿瘤医院刘翠翠博士为该论文的第一作者,余科达教授为通讯作者。
据了解,余科达教授团队长期针对不同分子分型的乳腺癌开展多层次多模态的转移机制和治疗新靶点探索,取得了多项创新性成果。以通讯作者在JAMA Oncol、Lancet Oncol、JCO、Nature Commun、Adv Sci、Sci Adv、 JNCI、JCI Insight、Cancer Res、Clin Cancer Res等国际重要刊物上发表论文,成果纳入国内外多项权威性乳腺癌诊疗指南如美国NCCN指南、ASCO指南、德国AGO指南及中国CBCS指南,形成广泛的学术影响力和临床价值。目前,余科达教授课题组正招收科研助理(具体参见复旦大学附属肿瘤医院官网-人才招聘信息),长期有效。
联系人:邢先生 | 手机号码:138-1092-1567
